SIFAT FISIK DAN SIFAT KIMIA SENYAWA ALKANA
Senyawa
alkana merupakan senyawa hidrokarbon jenuh (ikatan antar atom C berupa ikatan
tunggal). Alkana memiliki rumus umum CnH2n+2.
A. Sifat Fisis
Alkana
merupakan seyawa kovalen yang memiliki
titik didih dan titik leleh yang relatif rendah. Adapun hubungan titik didih
dengan massa molekul relatif (Mr) senyawa alkana dapat dilihat pada Tabel 1 di
bawah ini.
Tabel
1. Data Massa Molekul Relatif, Titik Didih, dan Titik Leleh Beberapa Senyawa
Alkana
Nama
|
Rumus Molekul
|
Mr
|
Titik didih (oC)
|
Titik
leleh (oC)
|
Metana
|
CH4
|
16
|
-183
|
-162
|
Etana
|
C2H6
|
30
|
-172
|
-88,5
|
Propana
|
C3H8
|
44
|
-187
|
-42
|
n-butana
|
C4H10
|
58
|
-138
|
0
|
Isobutana
|
C4H10
|
58
|
-159
|
-12
|
n-pentana
|
C5H12
|
72
|
-130
|
36,0
|
Isopentana
|
C5H12
|
72
|
-160
|
28
|
Neopentana
|
C5H12
|
72
|
-17
|
9,5
|
Heksana
|
C6H14
|
86
|
-95
|
69
|
Heptana
|
C7H16
|
100
|
-90,5
|
98
|
Oktana
|
C8H18
|
114
|
-57
|
126
|
Nonana
|
C9H20
|
128
|
-54
|
151
|
Dekana
|
C10H22
|
142
|
-30
|
174
|
Undekana
|
C11H24
|
156
|
-26
|
196
|
Dodekana
|
C11H26
|
170
|
-10
|
216
|
Tridekana
|
C13H28
|
184
|
-6
|
234,0
|
Tetradekana
|
C14H30
|
198
|
5,5
|
252
|
Pentadekana
|
C15H32
|
212
|
10,0
|
266
|
Heksadekana
|
C16H34
|
226
|
18
|
280
|
Heptadekana
|
C17H36
|
240
|
22
|
292
|
Oktadekana
|
C18H38
|
254
|
28,0
|
308
|
Nonadekana
|
C19H40
|
268
|
32,0
|
326
|
Eikosana
|
C40H42
|
280
|
36
|
-
|
Suatu zat
yang memiliki titik didih kurang dari 25oC, pada keadaan standar (25oC,
1 atm) zat tersebut berwujud (fase) gas. Zat yang memiliki titik leleh kurang
dari 25oC dan titik didihnya di atas 25oC, dalam keadaan
standar zat tersebut berwujud (fase) cair.
Berdasarkan
Tabel 1, dapat disimpulkan bahwa senyawa alkana :
a) dari CH4 sampai C4H10
berwujud gas
b) dari C5H12 sampai C17H36
berwujud cair
c) dari C18H38 ke atas
berwujud padat
Perbedaan
titik didih dan titik leleh dari isomer senyawa heksana (C6H14)
dapat diamati pada Tabel 2 berikut :
Tabel
2. Titik Didih dan Titik Leleh Isomer Heksana (C6H14)
Stuktur
|
Nama
|
Titik didih (oC)
|
Titik
leleh (oC)
|
CH3 ─ CH2 ─ CH2
─ CH2 ─ CH2 ─ CH3
|
n-heksana
|
69
|
-95
|
CH3 ─ CH2 ─ CH2
─ CH2 ─ CH3
|
CH3
|
2-metilpentana
|
60
|
-154
|
CH3 ─ CH2 ─ CH2
─ CH2 ─ CH3
|
CH3
|
3-metilpentana
|
63
|
-118
|
CH3
|
CH3 ─ CH2 ─ CH2
─ CH3
|
CH3
|
2,2-dimetilbutana
|
50
|
-98
|
CH3 ─ CH2 ─ CH2
─ CH3
| |
CH3 CH3
|
2,3-dimetilbutana
|
58
|
-129
|
Tabel 1
dan 2 di atas menjelaskan bahwa :
a) titik didih dan titik leleh alkana
ditentukan oleh banyaknya atom karbon dan struktur rantai atom karbonnya.
Semakin panjang rantai karbon alkana maka semakin tinggi titik leleh, titik
didih, dan massa jenisnya;
b) untuk jumlah atom karbon yang sama,
isomer dengan rantai karbon tidak bercabang memiliki titik didih dan titik
leleh yang lebih tinggi dibandingkan dengan isomer dengan rantai karbon
bercabang;
c) semakin banyak cabang pada rantai
karbonnya maka semakin rendah titik didih dan titik lelehnya.
A. Sifat Kimia
Senyawa alkana
ini bersifat kurang reaktif dibandingkan alkena dan alkuna karena memiliki
affinitas yang kecil sehingga sering disebut paraffin. Namun, senyawa alkana
dapat mengalami reaksi pembakaran (oksidasi). Pada pembakaran sempurna senyawa
hidrokarbon menghasilkan gas CO2 dan uap air (H2O).
Senyawa alkana juga dapat mengalami reaksi subtitusi, dimana satu atau lebih
atom H dari alkana dapat digantikan oleh atom atau gugus atom lain.
Contoh : pembakaran
(oksidasi) propana
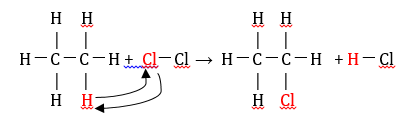
Alkana bereaksi
dengan halogen di bawah pengaruh panas atau sinar ultraviolet. Pada reaksi
halogenasi kereaktifan halogen dalam subtitusi adalah Cl > Br > I.
Contoh : klorinasi etana
Selain
itu, alkana juga dapat mengalami proses cracking
yaitu pemanasan alkana pada suhu dan tekanan yang tinggi tanpa oksigen sehingga
terjadi pemutusan rantai atau pembentukan senyawa-senyawa yang tak jenuh.
Cracking adalah suatu metode untuk mengubah
senyawa-senyawa bermolekul besar seperti dekana menjadi senyawa-senyawa yang
bermolekul lebih kecil yang lebih berguna sebagai bahan bakar atau dalam
industri kimia.
Contoh :






Tidak ada komentar